

上一期依然讲过BRAF基因与甲状腺癌之间的关系(详见“甲状腺癌与BRAF基因之间的那些事”),这一期咱们将围绕RET基因,为环球解开RET基因与甲状腺癌之间的谜团。
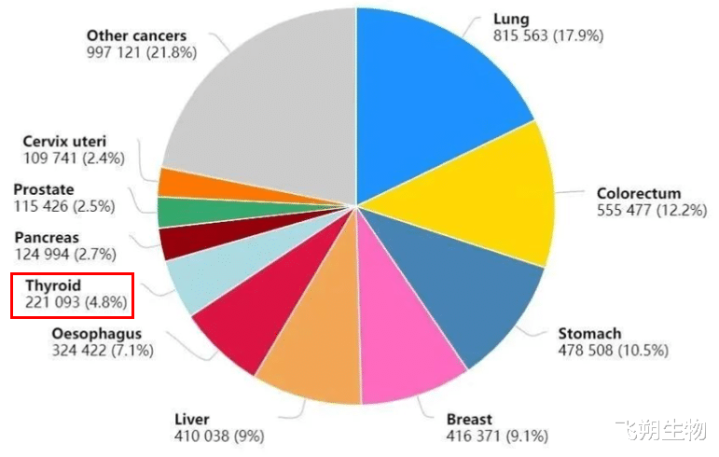
图1 2020年中国癌症新发病例数前十的癌症
频年来,甲状腺癌的发病率在包括我国在内的全球多个国度和地区呈现握续快速高涨态势。全球年新发病例高达近60万,中国患者约占其中1/3以上(图1),女性和男性患者的比例约3:1[1]。
RET基因发现于1985年,是一种原癌基因,位于10号染色体长臂(10q11.2),长约60kb,包含21个外显子。RET基因编码受体酪氨酸激酶卵白,不错协调细胞的增殖、助长、分化、移动和凋一火;在器官的生成以及神经系统发育历程中也发达迫切作用,还与男性精子的产生相关[2]。RET卵白由三个结构域构成:一个胞外结构域,具有四个钙粘卵白样访佛序列和一个富含半胱氨酸的区域;一个跨膜结构域;以及一个胞内酪氨酸激酶结构域。RET卵白有三种亚型,离别为RET 51(长51-氨基酸)、RET 43(中43-氨基酸)、RET 9(短9-氨基酸),它们在抒发的时空调控、细胞定位和转运以及生物学功能上存在互异。其中RET 51和RET 9为主要亚型,两者皆高度保守,但RET 51比RET 9更有用地促进细胞增殖、移动和锚定[3](图2)。
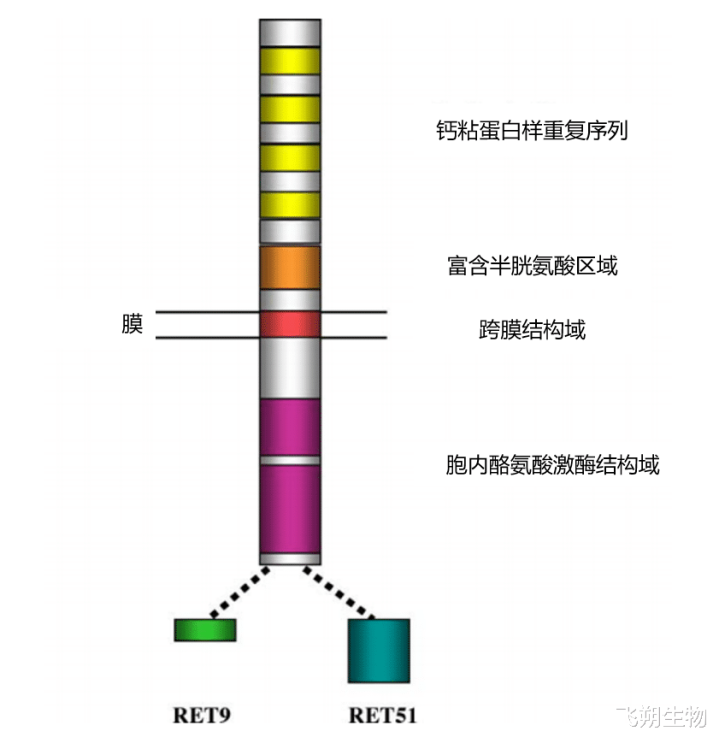
图2 RET卵白的结构线路图
RET基因是若何参与调控细胞的助长周期?又是若何引起肿瘤的发生?RET卵白参与RAS-MAPK、PI3K-AKT、JAK-STAT和PKC等细胞信号通路,即参与了细胞的助长、增殖、分化、凋一火等细胞周期历程。但是,只须激活的RET卵白智力激活卑鄙的信号通路,发达调控功能。现相干标明:RET卵白的激活需要GDNF家眷配体(GFLs)与GDNF家眷受体-α(GFRα)两者结合参与。GFLs类型稠密,除了胶质细胞系源性神探求养因子(GDNF)除外,还包括神经动素(NRTN)、青蒿素(ARTN)和波斯芬(PSPN)。在配体GDNF、NRTN、ARTN和PSPN离别与受体GFRα1、GFRα2、GFRα3和GFRα4结合的作用下,GFLs-GFRα复合物与RET的结合触发了其同源二聚化、酪氨酸残基的磷酸化和随后的细胞内信号转导,从而参与了细胞助长周期的调控[4-5](图3)。
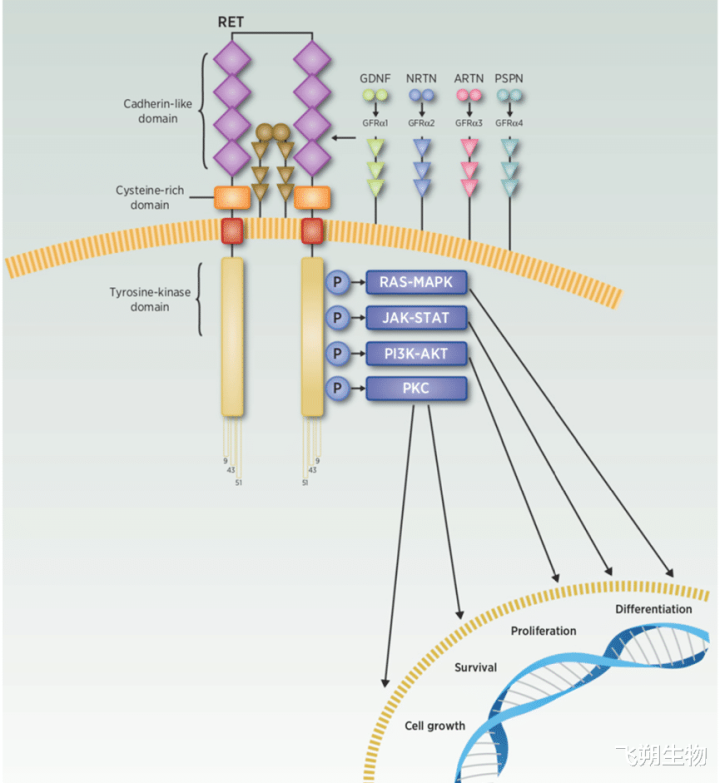
图3 RET信号转导通路
RET基因变异的乳头状甲状腺癌(PTC)
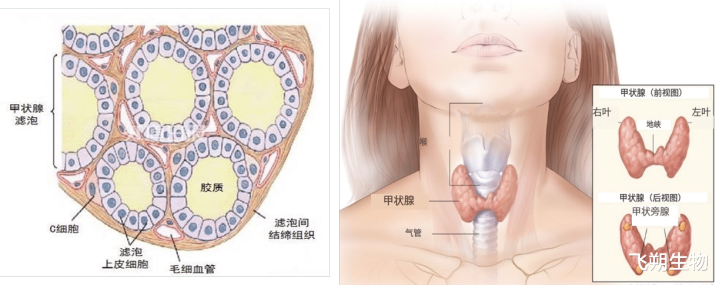
图4 甲状腺
甲状腺癌是最常见的恶性内分泌肿瘤,发祥于甲状腺滤泡上皮或滤泡旁上皮细胞(图4)。凭证肿瘤发祥及分化互异,甲状腺癌可分为分化型甲状腺癌(DTC)、甲状腺髓样癌(MTC)、低分化甲状腺癌(PDTC)和未分化甲状腺癌(ATC),其中DTC又分为乳头状甲状腺癌(PTC)和滤泡状甲状腺癌(FTC)。在统统的组织分型中,PTC最为常见,约占一齐甲状腺癌的90%,MTC较为冷漠,约占3%。相干标明,RET基因变异最常发生在PTC和MTC中,其中PTC主要发生RET重排,MTC主要发生RET突变。比拟PTC中最常见的BRAF突变,RET重排在PTC中发生的频率不是很高,约占10%~20%,且RET重排与BRAF突变之间互斥。RET基因断裂点常出当前11号内含子,偶尔出当前7号和10号内含子,导致编码激酶结构域3′端和其它伴侣基因的5′端发生了倒位或易位,从而导致RET激酶被激活,并产生嵌合癌卵白,最终引起肿瘤的发生[6-8](图5)。
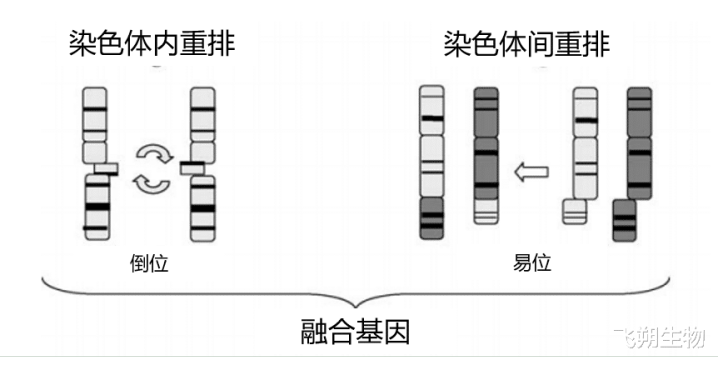
图5 RET重排
迄今收敛,已有跳跃35个基因与RET形成交融基因,其中CCDC6-RET和NCOA4-RET是PTC中最常见,离别被定名为RET/PTC1和RET/PTC3,占PTC RET重排类型中的60%和30%(图6)。而变成RET重排常见的要素是电离辐射,据报说念,曾受到切尔诺贝利发射性千里降物或日本原枪弹影响的PTC患者中,RET重排发生率为50%~80%,而且儿童比成东说念主更常见。佩带RET重排的年青甲状腺癌患者频频早期出现包膜外侵、淋联结回荡和迢遥回荡,分期较高。追念性相干露出,RET/PTC重排对Bethesda Ⅲ类结节恶性会诊率为60%,无假阳性存在,指示 RET/PTC重排是PTC会诊特异性卓绝高的象征物。我国的众人共鸣提议:伴有RET重排的PTC恶性进程更高,提议尽早积极外科手术养息[6-8]。
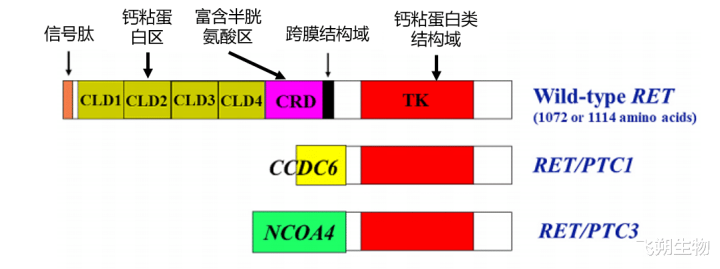
图6 RET重排主要类型(甲状腺癌)
RET基因变异的甲状腺髓样癌(MTC)
MTC是一种由降钙素(Ctn)分泌的滤泡旁C细胞引起的恶性肿瘤。凭证疾病的遗传特色,将MTC分为遗传性(20%~25%)和懒散性(75%~80%)两大类。确切统统的遗传性MTC(HMTC)皆伴有RET基因的胚系突变,并通过染色体显性遗传;50%的懒散性MTC有RET基因的体细胞突变。HMTC以多发性内分泌肿瘤详尽征2型(MEN2)中的一部分发病,凭证临床特征可分为三个亚型:MEN2A、MEN2B 和家眷性甲状腺髓样癌(FMTC)。MEN2A是最常见的亚型,在MEN2家眷中占60%~90%;MEN2B占5%,恶性进程较高;FMTC是MEN2最“惰性”亚型,发病较晚[7、9]。
RET基因突变与MEN2A
95% MEN2A患者与RET基因突变热门邻接在RET胞外富含半胱氨酸的区域的6个半胱氨酸残基,主如果10番外显子中密码子609、611、618和620,以及11番外显子中密码子630和634中的半胱氨酸常发生替换,这些位点以其它氨基酸取代半胱氨酸,减少分子内二硫键形成,通过RET单体分子间二硫键促进RET同型二聚体形成,导致RET非配体握续激活[7、9、10](图7)。
RET基因突变与FMTC
FMTC患者RET突变不仅存在于胞外半胱氨酸残基,也存在于胞外和胞内的其它非半胱氨酸残基,如Gly533Cys(G533C)(RET胞外结构域8番外显子)、Glu768Asp(E768D)、Leu790Phe(L790F)、Tyr791Phe(Y791F)、Val804Met/Leu(V804M/L)和Ser891Ala(S891A)(RET激酶结构域13-15番外显子)[7、9、10](图7)。
RET基因突变与MEN2B
MEN2B患者与RET基因激酶结构域关系,95%的MEN2B病东说念主佩带RET基因16番外显子M918T突变,不及5%的病东说念主佩带15番外显子A883F突变。这些突变不错篡改卵白质构象,加多ATP结合亲和力,裁减自己遏止[7、9、10](图7)。
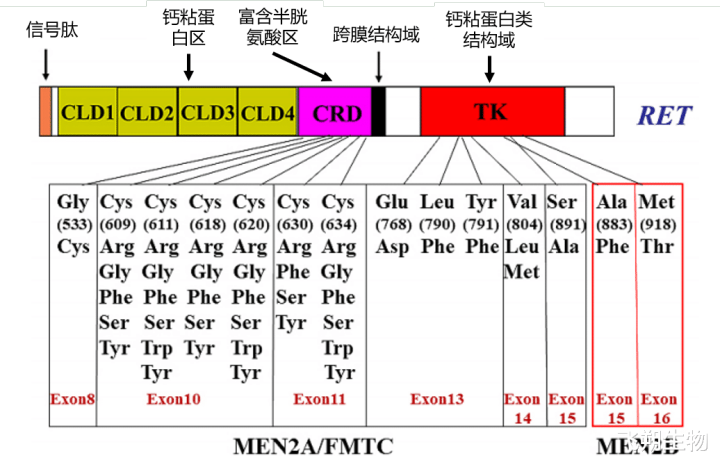
图7 MEN2家眷RET基因突变类型
RET基因突变与懒散性MTC
懒散性MTC大多存在RET基因的体细胞突变。M918T是最常见的位点(约80%),第二常见突变位点是C634突变(约15%),其它稀有的体细胞突变波及A883、C609、C630等位点。相干标明,RET基因M918T体细胞突变与MTC侵袭性关系,因此,指南提议对晚期MTC、权术进行取舍性RET遏止剂养息的患者行体细胞RET突变检测。天然是懒散性疾病,但相干露出仍然有1%~7%懒散性MTC患者实质上患有遗传性疾病,故指南指出:懒散性MTC患者应进行遗传扣问和检测RET突变情况(在懒散性MTC中,RET突变与HRAS、KRAS突变相互摈斥)[7、9、10]。
RET基因突变位点的危机度分层
当前发现跳跃100种RET基因的点突变、拷贝数变异、插入或缺失变异等与遗传性MTC相关,而不同的突变位点所致肿瘤的恶性进程亦不雷同,可分为最高危组、高危组和中危组(图8),不同的风险进程将聘请不同的决策进行堤防及养息[7、9、10]。
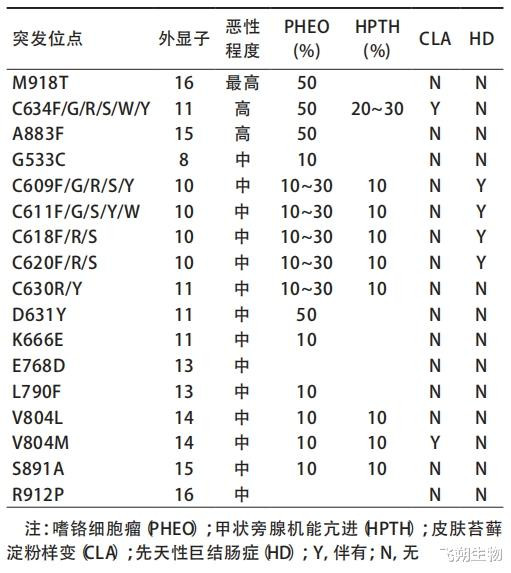
图8 RET基因突变位点与遗传性甲状腺髓样癌的恶性风险
要而论之,RET基因变异与甲状腺癌密切相关,卓绝是在乳头状甲状腺癌(PTC)和甲状腺髓样癌(MTC)中。RET/PTC重排也可行为甲状腺结节良恶性会诊的象征物,同期也能提拔会诊遗传性甲状腺风险进程,以实时作念好堤防。
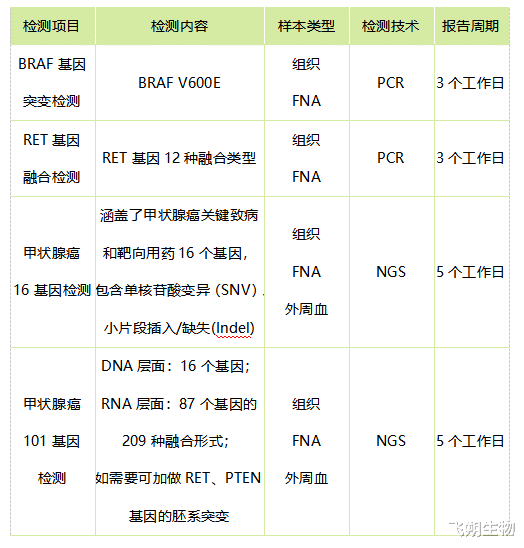
飞朔生物甲状腺癌基因突变检测,成心于科学精确评估个体患甲状腺癌的风险,制定个性化处置决策。
飞朔生物甲状腺癌基因检测
参考文件
[1]IARC 2020年全球最新癌症包袱数据.
[2]Cytokine & growth factor reviews,2005,16(4-5): 441-467.
[3]Cytogenet Cell Genet 2001,95:169-76.
[4]Nature reviews Clinical oncology,2018,15(3):151-167.
[5]JMA J, 2020, 3(3): 175-181.
[6]甲状腺癌诊疗指南(2022年版)
[7]甲状腺癌RET基因检测与临床行使众人共鸣(2021版)
[8]甲状腺癌基因检测与临床行使广东众人共鸣(2020版)
[9]甲状腺髓样癌会诊与养息中国众人共鸣(2020版)
[10]甲状腺髓样癌诊疗CSCO指南(2022版)
